

肌萎缩性脊髓侧索硬化症

因中枢神经系统内控制骨骼肌运动的神经元退化导致的肌萎缩性脊髓侧索硬化症(Amyotrophic lateral sclerosis: ALS,也称渐冻人症)是一种渐进且致命的神经退行性疾病。由于运动神经元退化和死亡,肌肉逐渐萎缩致大脑完全丧失控制随意运动的能力,最终会造成发音、吞咽,以及呼吸和运动障碍。著名物理学家霍金就是一名ALS患者。目前还没有真正可有效治疗ALS的药物和方法。>>>商务洽谈,点此处,在线咨询
绝大多数(90-95%)的ALS发病原因不明,但也有约5-10%的ALS患者表现出了家族遗传性,其中超氧化物歧化酶 1(Superoxide Dismutase 1:SOD1)基因突变约占这些遗传性ALS病例的10%。SOD1也是第一个被鉴定出来的ALS风险基因[1],因此很快就有科学家构建了一种含有第93位甘氨酸突变为丙氨酸(G93A)的人SOD1基因的转基因小鼠模型,全名为B6SJL-Tg(SOD1*G93A)1Gur/J转基因小鼠[2]。该转基因小鼠基因组中被转入了23个拷贝的人源SOD1*G93A突变基因,接下来我们将其简称SOD1*G93A转基因小鼠。

图二:SOD1*G93A转基因小鼠是以B6和SJL杂交子代为背景品系,通过原核注射和胚胎移植得到的转基因小鼠模型,因此其毛色多样,图片来自Jax实验室(https://www.jax.org/strain/002726)
自1996年SOD1*G93A转基因小鼠问世以后,其就被广泛应用于ALS药物研发的临床前动物试验中。到2004年,短短8年时间内,已至少有50篇文章描述了从小分子到病毒载体的各类ALS治疗方案,可延长SOD1*G93A转基因小鼠的寿命,其中最长可以延长寿命100天(78%的寿命延长)。这些药物很快进入临床试验,然而,迄今为止,除了利鲁唑(最多延长ALS患者两个月寿命)之外,没有任何一种药物显示出对人类ALS疾病的进程有显著影响[3]。这给医药公司带来了巨大损失,如2008年在美国国家科学院院刊上发表的一篇文章显示锂可以将SOD1*G93A转基因小鼠的存活时间延长30天[4]。由于锂早已经被用于治疗精神分裂症,许多ALS患者开始超说明书服用该药物,希望减缓疾病进程。然而,招募了数百名患者,花费了远超1亿美元的三个同时启动的独立III期临床试验结果却显示锂对ALS无任何治疗效果。

其实不仅仅是ALS的药物研发,在整个医药研发领域,动物实验结果的平均临床转化率也是非常低的,平均在11%左右 。那么到底是什么原因导致了如此高比例的动物实验结果无法实现在人类的临床转化呢?
1999年,美国麻省理工学院的机械工程师詹姆斯·海伍德在得知他的哥哥史蒂芬·海伍德被确诊患有ALS,并无任何有效治疗方法后,与家人一起创立了一家非盈利性生物技术公司,即ALS 治疗开发研究所 (ALS-TDI)。ALS-TDI成立后开展了一项旨在寻找SOD1*G93A转基因小鼠实验结果临床转化失败原因的项目,即使用SOD1*G93A转基因小鼠重复已发表科研论文中的动物实验,以找出其临床转化失败的原因。
在ALS-TDI开展的重复性实验中,他们不仅严格执行盲法对照,而且对给药组和对照组的动物进行了更为精细的分配和动物筛查以排除系统误差。他们分组及实验要求包括:
⑴ 年龄匹配;
⑵ 性别匹配;
⑶ 同窝匹配:即使用同一天出生的同一非转基因母亲和转基因父亲的后代进行分组,具体来说,治疗组中的每个雄性(和雌性)在对照组中都有一个同窝兄弟(和姐妹);
⑷ 样本量设定:每组使用动物数量为24只(12雌,12雄);
⑸ 死因筛查:检查记录每一只动物的死亡原因,排出非ALS致死个体;
⑹ 转基因拷贝数监控:有研究证明SOD1*G93A转基因小鼠在传代过程中会出现转基因拷贝数丢失的现象,且低拷贝的转基因小鼠的平均寿命会加长。
在这一严格实验分组和动物筛查条件下,ALS-TDI的科研人员总共使用了5429只SOD1*G93A转基因小鼠测试了包括利鲁唑在内的100多种(大部分已有论文发表并证明可延长SOD1*G93A转基因小鼠寿命)候选化合物,却没有发现任一化合物表现出可延长SOD1*G93A转基因小鼠寿命的效果(图三)。
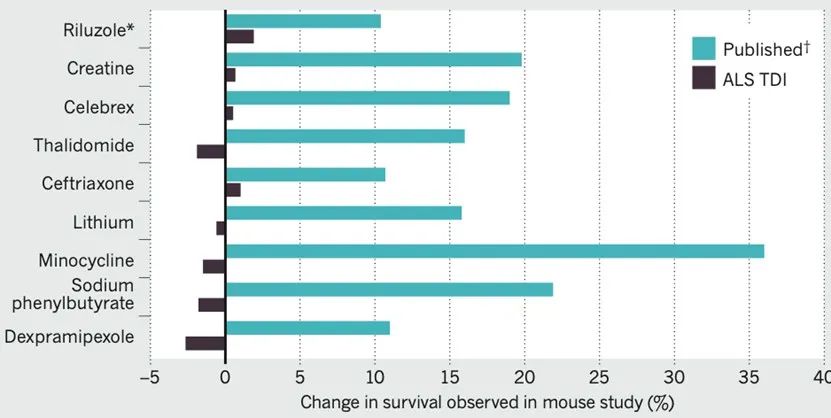
图三:ALS-TDI以SOD1*G93A转基因小鼠开展的重复实验结果与已发表实验结果对比[3]
为找出导致那些已经发表实验结果无法被重复的原因,他们以在ALS-TDI开展实验中所使用的2000多只对照小鼠作为研究对象,进行了计算机分组模拟实验。由于这些小鼠从出生到死亡及死亡原因的信息在ALS-TDI都有详细的记录,因此他们能够以所有对照小鼠为数据库,分析前述重复实验中设定的不同分组和动物筛查条件对实验结果的影响。即通过计算机对这些没有经过任何药物处理的小鼠进行分组,将一组设为假定的实验组,而另一组设为假定的对照组,然后依据已有的小鼠死亡时间记录,统计两组小鼠之间是否存在显著差异。经过多次重复,计算出现5%以上显著差异的百分比。由于这些对照小鼠没有接受过任何化合物处理,因此如果假定的实验组和对照组中出现了显著性差异,那么其来源应该是分组时的系统误差。
结果显示,在样本量大小为4的计算机分组模拟对比实验中,在随机分组和不进行死因筛查及排除低转基因拷贝数个体条件下,两组间出现显著差异的可能性超过了50%。而随机分组的同时进行死因筛查并排除低转基因拷贝数个体和进行性别匹配的分组条件下,样本量为4的模拟分组实验中也有30%的可能出现两组死亡时间的显著差异(图四)。随着样本量的增加,出现显著性差异的可能性逐渐减少,但要实现低于5%(统计学上通常设置的显著置信区间)的显著性差异,样本量要达到每组24只动物。如果不做分组条件控制,即使样本量到50只也难以排除系统误差。
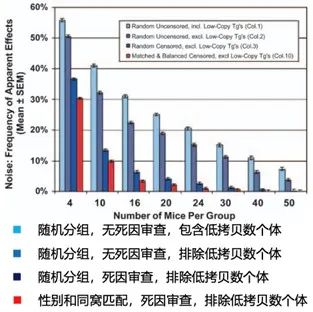
图四:分组条件导致的系统误差[3]
ALS- TDI的这个计算机模拟实验结果说明,前述那些已经发表的基于SOD1*G93A转基因小鼠实验结果无法实现临床转化的真正原因极大可能源于其实验设计的不合理。这些实验因为没有排除分组时的系统误差而导致了假阳性结果。这个研究也暴露了当下使用实验动物开展研究的诸多问题,如盲目地追求减少使用动物的数量;对所用动物遗传、微生物和繁殖等特性不了解;实验过程中对动物关注不够,不清楚动物发病或死亡的真正原因等。这些问题不仅仅需要引起实验动物从业人员的注意,科研人员同样需要给予关注。因为实验设计不严谨导致的假阳性结果不仅是人力、物力和财力的巨大浪费,也严重有违动物实验伦理福利,这样的实验不会带来科学进步,且浪费了大量实验动物的生命。比如在ALS-TDI开展的无法重复出已发表结果的实验中,那些已经发表的工作累计使用小鼠的数量就超过了18000只。此外,在动物实验伦理申请时常用替代、优化和减少(俗称3R原则)原则来指导伦理审查工作,有时为了满足3R原则中的“减少”原则,加上开展实验成本的考虑,往往选择使用最少的动物数量(比如多为每组6只),但从ALS-TDI的这个研究看,样本量过小,会导致系统误差加大,因此极大可能出现假阳性结果。这个时候大家或许忘了3R原则使用的大前提是要能够实现拟开展实验的科学目标,如果单纯为了“减少”而使用更少的实验动物导致科学目标无法实现,那不是减少,而是对动物生命的漠视。
来源:实验动物那些事儿
相关阅读:
标准化模式动物实验室建设 CEIDI西递
ABSL-2实验室资质审批及实验申请
SPF实验动物房环境控制及净化空调节能方案
上海市虹桥商务区富力环球中心
Copyright © 2012-2023 CEIDI西递 版权所有 沪ICP备11045524号




